原文链接:科技蜀光丨“内外夹击”让肿瘤无处可逃,这项技术将宫颈癌局部控制率提高10%
宫颈癌位居全球女性癌症发病率第4位,而我国病例数占全球近1/4,多名患者就诊时已是局部晚期,面临一系列关键问题——宫颈癌治疗中如何同时兼顾抗肿瘤治疗效果和正常组织防护?大体积不对称性宫颈癌患者用常规治疗办法不管用,怎么办?
9月10日,全省科技大会在成都举行,授予231项科技成果“四川省科学技术进步奖”。其中,由四川省肿瘤医院主持完成的《宫颈癌无创治疗关键技术创新与应用》荣获2023年度四川省科学技术进步奖二等奖。团队历时10年,围绕上述关键问题开展系列研究和关键技术攻关,将适用该技术的局部晚期大肿瘤宫颈癌患者的局部控制率由82%提高到92%、为不能进行插植放疗的患者提供挽救生命的治疗方案。
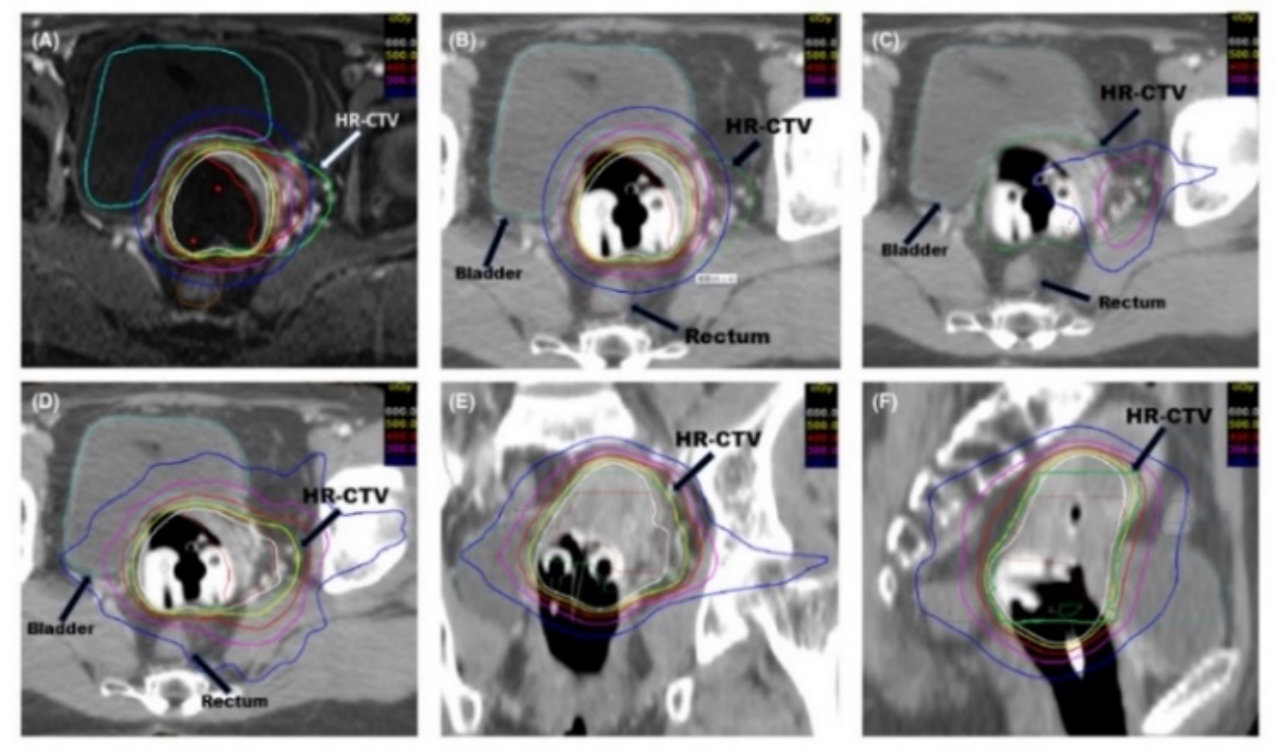
项目团队成功模拟出近似插植治疗的计量梯度,为无法进行插植治疗的大体积不对称性/外照射后消退欠佳的宫颈癌患者提供了有效解决方案。项目团队供图
过去对“大体积不对称性病变”肿瘤难以做到“全面击杀”
据项目团队介绍,与国外相比,我国宫颈癌治疗有两个特点,一是大部分患者就诊时已是局部晚期;二是预后不理想,即使完成根治性治疗,我国仍有30%到50%的患者肿瘤控制欠佳,或因原来发病部位出现肿瘤复发导致治疗失败,5年生存率仅60%左右,显著低于欧美先进国家70%的生存率。项目负责人、省肿瘤医院副院长路顺分析,导致这些现象的主要原因在于,2013年项目开展以前,我国已有的宫颈癌治疗手段无法同时满足“高效的抗肿瘤治疗效果”以及“满意的正常器官保护”。
不管是什么类型的宫颈癌肿瘤,业内多会采取常规的三维后装治疗手段。“这个手段是‘基本款’,一般在三维CT重建技术帮助下,将放射源通过三管式施源器(用于近距离放射治疗的特殊容器)插入肿瘤进行放射治疗,相当埋3个‘雷’定向爆破,适合击杀‘标准款’肿瘤,但有其局限性。”路顺解释道。
由于放射源紧邻直肠和膀胱,一旦施源器位置确定,很难根据靶区(需要照射的肿瘤区域)和危及器官的位置做剂量优化,为保护正常器官,许多情况下不得不牺牲靶区剂量。而在我国局部晚期宫颈癌中,大体积不对称性病变的患者相对常见。
“对付这些‘个头大’又‘不对称’的‘刺头肿瘤’,用‘基本款’手段难以全面击杀。以前只有让‘弹药’(放射源)击杀范围大一点、驻留时间长一点,但患者瘤周正常器官毒副反应也可能会增加。后来,业内开始考虑‘插植放疗’——在已埋3个‘雷’基础上,同时再埋1次‘雷’,用施源器进入肿瘤内部‘扎营’,再将放射源送到施源器内,精准杀灭剩下的肿瘤细胞。”
路顺表示,插植放疗这种近距离的后装治疗技术因难度高,我国大部分单位无法实现,且部分患者因身体条件无法接受该种治疗。
项目团队成员正在开展相关治疗。项目团队供图
“内外夹击”让肿瘤细胞无处可逃、且不增加毒副反应
如何“彻底”又“安全”地解决大体积不对称性肿瘤的治疗困境?不能插植放疗的患者咋办?
10多年以前,医院在国内首创宫颈癌内外融合照射新模式——“体外照射是‘照光’,体内照射就是体内‘埋雷’。内外融合照射新模式,就是‘埋雷’定向爆破肿瘤后,5分钟内通过专用转运床把患者运至加速器‘照光’,给没照射到的肿瘤‘补刀’(补量),让整个肿瘤比较均一地受到足量照射,且毒副反应不增加。”路顺说。
如今,团队已完成全球首个内外融合照射临床研究,研究成果经国内40家医疗单位推广应用,受益患者一年超过5000例。
内外融合照射看似是简单叠加,背后却是无数次的流程优化和精准计算。“埋雷要准,转运要快,几分钟内还要规划靶区、对患者进行体外照射,离不开前后方的紧密衔接、流程的严丝合缝、剂量的合理分布,我们摸索了很长时间,想了很多新点子,有了很多新发明。”路顺举例,项目团队成员李林涛自2018年起进行“放疗中自动解锁体架板”的临床转化研究,如今已实现成果转化。“转运过程中,放疗患者如果遇到突发情况,手一碰,体架就会自动弹开。”
从临床需求中来,到患者普惠中去,一直是项目团队的主要遵循。10年来,项目团队形成宫颈癌生物精准化治疗解决方案,率先开展宫颈癌磁共振引导的实时在线自适应调强放疗新技术,通过实时扫描获取器官的形状变化和位置移动,更准确地打击肿瘤,也不伤害近在咫尺的正常组织.......目前,研究成果在复旦大学附属肿瘤医院、山东省肿瘤医院等全国多家医疗单位推广应用超过3年。
“这次获奖我们很受鼓舞,但要做的还有很多。患者的痛点是我们每次重新出发的动力。”路顺抛出几个问题——“同样的治疗方法,为什么有的宫颈癌患者就是治不好?当患者的肿瘤组织‘抵抗’放射治疗时,如何让肿瘤细胞‘放弃抵抗’,提高患者的放疗敏感性?”路顺表示,近年来,他带领项目团队以临床问题为导向,探讨宫颈癌放射抵抗的生物学机制,同时开展大规模临床样本验证,提高项目临床转化价值,为优化宫颈癌标准化治疗决策提供更多循证医学证据,造福更多患者。


